El artículo “Normas de Bioseguridad para Fibrina Leucoplaquetaria Autóloga L-PRF en Odontología” ha sido especialmente escrito para el Blog Bioseguridad para celebrar la 1ª Semana de Bioseguridad en Odontología de América Latina por:
Maria Claudia V. Guimarães, DDS, Ms,
Maestra en Cirugía y Traumatología Bucomaxilofacial, Especialista en Cirugía y Traumatología Bucomaxilofacial y en Implante. Acreditación en Odontología Hospitalaria. Staff del Hospital Dr. Munir Rafful y ministra clases de Bioseguridad en el pos-grado en Implantodoncia.
GerAção Biosegurança (GenerAcción Bioseguridad)
1. Conceptos
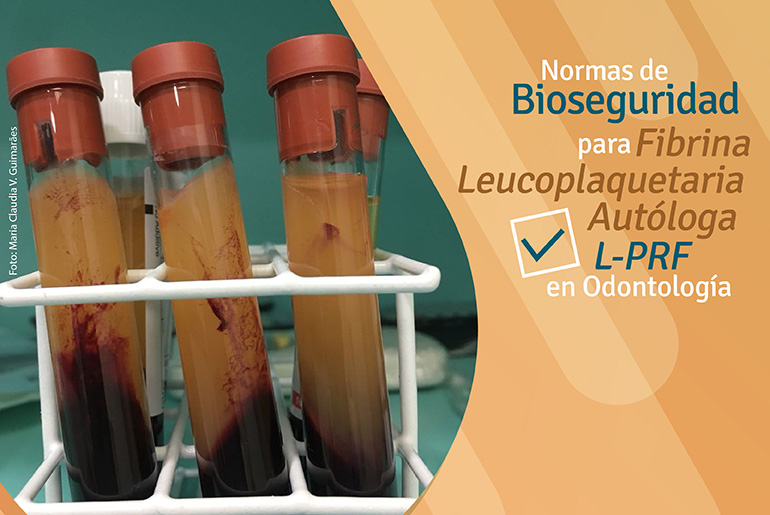
El reciente desarrollo de los agregados plaquetarios es conocido como fibrina rica en plaquetas y leucocitos (L-PRF), fibrina rica en plaquetas de Choukron (Choukron’s PRF) o apenas fibrina rica en plaquetas (PRF). En este protocolo desarrollado en Francia, es realizada una punción venosa y la sangre es colectada en tubos de vacío de 10mL. No se agrega ningún anti coagulante, inmediatamente una única centrifugación es realizada a 2.700 rpm, aproximadamente 400g de fuerza, por 12 minutos.
El contacto de la sangre con el tubo de ensayo inicia la cascada de coagulación. La polimerización lenta de la red de fibrina, durante la centrifugación para la producción de L-PRF, genera una red de fibrina similar al coágulo natural, hecho este que favorece la migración y la proliferación celular, que mejora el proceso de angiogénesis y reparación.
Tendremos, por lo tanto, una matriz de fibrina autóloga constituida por leucocitos, plaquetas, factores de crecimiento y células mesenquimales indiferenciadas. La fibrina actuará en cuatro fases fundamentales del proceso de reparación: angiogénesis, control inmunológico, liberación de factores de crecimiento y células mesenquimales indiferenciadas, además de servir como una cobertura y un marco para la migración epitelial.
2. Indicaciones de Fibrina Leucoplaquetaria Autóloga L-PRF en Odontología
Entre las principales aplicaciones clínicas, se destacan:
- Coadyuvante en regeneración tisular guiada (RTG), en especial por su actividad angiogénica;
- Cobertura del lecho de heridas quirúrgicas que debido a su densidad natural, permite que sea suturada;
- Obliteración de rupturas de la membrana sinusal en cirugías de injerto del seno maxilar;
- Aglutinación de biomateriales particulados que optimiza los procesos de angiogénesis en el lecho del injerto;
- En alvéolos pos-exodoncia: sobre la forma de membranas para que se mantenga el volumen adecuado del hueso, disminuyendo también las características inflamatorias locales. Presentará un perfeccionamiento en la formación del coágulo sanguíneo, de forma a mejorar y acelerar el proceso de cicatrización;
- Tratamiento de Osteonecrosis mandibular inducida por Bisfosfonatos.
3 – Legislación – Resolución 158/2015 – CFO (de Brazil):
El término “agregados plaquetarios autólogos no transfusionales” esclarece el carácter autólogo y no transfusional de los productos obtenidos a partir de la sangre para uso en Odontología. Los agregados sanguíneos no son llamados de hemoderivados en la práctica odontológica, para evitar confusiones conceptuales con el área médica de hemoterapia y el uso transfusional de la sangre (Ministerio de la Salud – Portería 2712/2013).
La Resolución 158/2015 garantiza que el cirujano-dentista debidamente habilitado está apto a realizar la venopunción, sin necesidad de subordinación a otros profesionales del área de la salud. La obtención del L-PRF en el consultorio o centro quirúrgico está asegurada en la legislación por tratarse de un método en sistema cerrado, con bioseguridad preservada.
4 – Recomendaciones de Bioseguridad durante la venopunción:
4.1 – Torniquete
Aplicar el torniquete que deberá ser de uso único y libre de látex, posicionando el lazo hacia arriba con fin de evitar contaminación. Deberá ser colocado de 7,5 a 10,0 cm arriba del local de la punción para evitar la contaminación del local.
4.2 – Antisepsia de la piel
Realizada en el local de la punción, usada para prevenir la contaminación directa del paciente y de la amuestra, el antiséptico escogido debe ser eficaz, tener acción rápida, ser de baja causticidad e hipo-alergénico para piel y mucosa. El alcohol a 70% es frecuentemente utilizado y actúa contra bacterias Gram-positivas y Gram-negativas, teniendo buena actividad contra Mycobactyerium tuberculosis, hongos y virus. Además de tener un menor costo podrán ser utilizados también para la antisepsia de productos como alcohol isopropilíco a 70%, iodeto de povidona 1 a 10% o gluconato de clorexedina a 2%.
Técnica para antisepsia de la piel
Recomiéndase usar gasa humedecida con solución de alcohol isopropílico o etílico en la concentración de 70%, comercialmente preparado y limpiar el local con movimiento circular del centro para fuera. Permitir el secado por treinta segundos para prevenir hemólisis de amuestra y reducir la sensación de ardor en la venopunción. No tocar nuevamente en la región después de la antisepsia. Si la venopunción es difícil de ser obtenida y la vena necesita ser palpada nuevamente para efectuar la colecta, el local escogido deberá ser limpiado nuevamente.
Proceder con la higienización adecuada de las manos con agua, jabón y fricción de alcohol en gel a 70% y realizar el calzado de los guantes que pueden ser descartables de procedimiento confeccionados en látex, vinilo, polietileno o nitrilo. Es obligatorio el uso de Equipamientos de Protección Individual (EPI).
Más cuidados:
No usar el torniquete continuamente por más de un minuto y cambiar el torniquete siempre que hubiere sospecha de contaminación.
La posibilidad del desarrollo de un proceso infeccioso en el local de la venopunción, no debe ser rechazada, aunque sea rara. La antisepsia debe ser bien ejecutada y el área preparada para la punción no debe ser tocada después de este proceso. El tiempo entre la remoción del protector de aguja y el acto de la venopunción debe ser el menor posible.
El curativo adhesivo debe ser abierto solamente en el momento de la aplicación en la piel del paciente y mantenido por lo menos 15 minutos después de la colecta. La principal forma de transmisión de agentes infecciosos en la colecta se da por el contacto:
- directo (respingos de materiales biológicos que atingen piel y mucosas, accidentes perforo-cortantes, etc.,
- o indirecto (contacto de la piel con superficies contaminadas, contacto de mano contaminada con mucosas o piel que no esté intacta).
La otra forma de transmisión posible es la inhalación de aerosoles. La formación de aerosoles también puede ocurrir durante la preparación de amuestras.
4.4 Escalpes
Los escalpes son dispositivos usados para colecta múltiple de sangre a vacío. Algunos poseen dispositivos de seguridad, que al término de la punción, recobren o recogen la aguja, protegiendo de una contaminación por accidente corto-punzante. Exemplo Escalpes de Seguridad Push Button – BD Vacutainer Push Button – NR 32.
4.5 – Tubos de colecta de sangre a vacío
- La colecta de sangre a vacío es un procedimiento seguro y práctico. Consiste en un dispositivo que permite la aspiración del sangre directamente en la vena, a través del vacío utilizando una aguja de dos puntas que se conecta directamente al tubo de análisis, constituyendo el sistema para colecta de sangre.
- Son de uso único, su interior debe ser estéril y poseer vacío. Verificar si el producto está debidamente registrado en ANVISA y si es fabricado de acuerdo con las Buenas Prácticas de Fabricación establecidas por ANVISA y/o por otros estándares internacionales como ISO 6710.2, CLS; Food and Drug Administration (FDA) y Comunidad Europea (CE). Importante es importante verificar si el fabricante comprueba la funcionalidad de los tubos, preferencialmente por medio de documentación científica.
5 – Observar la NR 32 (de Brazil)
Establece las directrices para las medidas de protección y salud de los trabajadores de servicios de salud, bien como de aquellos que ejercen actividades de promoción y asistencia a la salud en general.
- 32.2.4.15 – Son vedados el re-encape y desconexión manual de agujas.
- 32.2.4.16 – Debe ser asegurado el uso de materiales corto-punzantes con dispositivo de seguridad.
- 32.2.4.17.1 – Inmunización activa contra el tétano, difteria, hepatitis B y los establecimientos en el Programa de Control Médico de Salud Ocupacional – PCMSO (NR 7).
6 – Centrifugación de los tubos y desinfección de las centrífugas
- Centrífugas deben ser sometidas periódicamente al mantenimiento preventivo, con calibración y verificación de las condiciones metrológicas para garantizar el funcionamiento correcto;
- Certifíquese de que los tubos estén correctamente encajados en el contenedor del centrífugo;
- Un encaje incompleto puede hacer con la tapa del tubo se desprenda, o que la parte superior del tubo se quede fuera del contenedor con riesgo de quiebra del mismo;
- Al final del día, los contenedores y el área de contacto del centrífugo deberán ser desinfectadas con hipoclorito de sodio a 1%.
7 – Recomendaciones después de la remoción de los tubos del centrífugo
Los tubos son nuevamente colocados en el soporte sobre el campo quirúrgico estéril y el cirujano que irá proceder con el preparo del L-PRF deberá estar debidamente paramentado, usando EPI, guantes y delantales estériles.
8 – Descarte Seguro de Resíduos – RDC – ANVISA – N. 222/2018 (de Brazil)
Grupo E: Implica materiales corto-punzantes. Se recomienda descartar separadamente, inmediatamente después del uso, en recipientes rígidos, resistentes a perforación, rupturas y fugas, con tapa debidamente identificada (Norma NBR 13853/57 de la ABNT), siendo expresamente prohibido reaprovechar los materiales. Las agujas descartables no deben ser encapadas nuevamente. El volumen de los recipientes de acondicionamiento debe ser compatible con la generación diaria de este tipo de residuo, siendo descartados cuando el interior atingir 2/3 de su capacidad o cuando esté a 5 cm de distancia de la boca del recipiente. Además de eso, deben estar identificados con el símbolo internacional de riesgo biológico, acrecido de la inscripción “CORTO-PUNZANTE”.
Grupo A1: Las sobras de muestras de laboratorio conteniendo sangre o líquidos corpóreos, pueden ser descartadas directamente en el sistema de recolecta de alcantarillas, desde que atiendan respectivamente las directrices establecidas por órganos ambientales, gestores de recursos hídricos y de saneamiento competentes.
¡Felicitaciones y gracias por el excelente artículo!